
|
evolutie, gevolgen en oplossingen een praktijkvoorbeeld: PRA door Dr.Leonie M.A. van Balen
Promotor : Dr. F. Coopman scriptie voorgedragen tot het behalen van haar diploma van dierenarts.
VOORWOORD
Allereerst wil ik hierbij mijn promotor hartelijk danken voor de tijd die hij in het begeleiden van mij bij het schrijven van deze scriptie heeft gestoken. Steeds was hij bereid mijn scriptie nog eens door te Iezen. Verder wil ik dank betuigen aart de mensen van de verschillende hondenrasclubs, en dhr. Ir. F. van Tatenhove van de Belgian Lhasa Apso Association en mevr. J. Offereins van de rasvereniging voor de Drentse patrijshond voor het helpen zoeken naar informatie. Zij hebben mij aan waardevolle informatie geholpen.
SAMENVATTING
In deze scriptie worden de risico's uitgelegd van het inbrengen van een erfelijke afwijking in een populatie via dieren die drager zijn van dit erfelijk gebrek. Deze dragers kunnen een gebrek ongemerkt verspreiden in een populatie. Aan deze dieren kan men namelijk geen symptomen ontdekken die wijzen op een erfelijk gebrek. De risico's die deze dieren met zich mee brengen zijn daarom zeer groot. Wanneer namelijk het gebrek tot uiting komt in de populatie, is het gebrek al sterk verspreid en zijn er niet alleen lijders (dieren die symptomen vertonen) maar zijn er nog veel meer dragers, iets wat het moeilijk maakt het gebrek te bestrijden. De evolutie, gevolgen en de oplossingen van zo'n erfelijk gebrek worden aan de hand van een praktijkvoorbeeld beschreven. Dit voorbeeld is PRA (progressieve retina atrofie) bij de hond. Dit is een erfelijke oogafwijking die enkelvoudig recessief wordt overgedragen en waarbij de aangetaste dieren uiteindelijk volledig blind worden.
INLEIDING 1
In fokprogramma's van runderen, varkens, kippen, paarden, honden en andere diersoorten is het gebruikelijk die dieren te kruisen die op basis van rasstandaard of economische parameters de beste fenotypische uitstraling hebben. Gehoopt wordt dat het gewenste fenotype een zo hoog mogelijke genetische achtergrond heeft. Dit maakt dat de nakomelingen sterker op hun ouders gelijken dan niet verwante dieren. Generatie na generatie zullen de uitgeselecteerde dieren fokzuiver verder worden voor de gewenste kenmerken. Door bloedlijnenteelt, wat inhoudt dat men in bepaalde fijnen steeds weer terug kruist op bloedlijn vertegenwoordigers die de gewenste kenmerken in optimale vorm vertonen en vererven, bekomt men een uniform type. Onderzoek van stambomen toont dat enkele topdieren op bijna elke stamboom voorkomen en dit zowel in de vader- als de, moederlijn. Zijn deze intensief ingezette topfokdieren drager van een erfelijk gebrek, dan kan het afwijkende gen (of genen) verspreid worden binnen het ras.
Afhankelijk van de wijze van overerven kan het gebrek bij aangetaste dieren in een vroeg of in een laat stadium tot uiting komen. Volledig dominante gebreken zullen reeds fenotypisch zichtbaar zijn in het fokdier zelf, waardoor zo'n dier logischerwijze niet ingezet wordt. Dragers van een kenmerk dat onvolledig dominant overerft kunnen fenotypisch volledig normaal zijn en rechtstreeks nakomelingen geven die het gebrek vertonen. Wanneer het gebrek recessief overerft, zal het gebrek pas bij paring van kleindochter met kleinzoon (die beide heterozygoot recessief zijn) tot uiting komen en dit in een op, de vier nakomelingen uit deze paring. Hierbij veronderstellen we dat het gebrek zich volledig manifesteert in homozygote toestand.
Beschouwt men in een verder geval recessieve, gebreken met onvolledige penetrantie of polygene afwijkingen dan kan men bedenken welk risico het inbrengen van een dergelijk erfelijk belast dier kan zijn voor een populatie. Vaak is reeds veel schade aangericht vooraleer men het gebrek opmerkt.
In het verleden zijn reeds een aantal van zulke gebreken opgedoken; zo kent men bij de Holstein Friesian de ziekte BLAD (bovine leucocyte adhesion deficientie), bij de, Araber CID (combined immunodeficientie) en bij verscheidene hondenrassen een aantal erfelijke oog problemen, waaronder PRA (Barnett, 1988).
Deze scriptie heeft tot doel het risico van inbrengen en, verspreiden van dergelijke erfelijke gebreken middels een literatuurstudie te beschrijven.
Om ten volle de impact van genen op het fenotype te begrijpen worden in een eerste luik een aantal begrippen uit de kwalitatieve, kwantitatieve en moleculaire genetica aangehaald.
In een tweede luik wordt de evolutie op, populatieniveau, gevolgen voor de populatie en mogelijke oplossingen weergegeven aan de hand van een praktijkvoorbeeld, namelijk PRA bij honden.
LITERATUURSTUDIE
1 ENKELE BEGRIPPEN UIT DE KWALITATIEVE, KWANTITATIEVE EN MOLECULAIRE GENETICA
1.1 KWALITATIEVE GENETICA
1.1.1 -wijzen van overerven
1.1.1.1 penetrantie
Penetrantie vertelt in welke mate het genotype in het fenotype tot uiting komt. Bij volledige penetrantie is het fenotype zoals het te verwachten is op basis van het genotype, onvolledige penetrantie duidt op invloeden die de veruiterlijking van het genotype bemoeilijken of verhinderen (Nicholas, 1987).
1. 1. 1. 2 enkel voudig dominant
Enkelvoudig wil zeggen dat bij deze wijze van overerven slechts een locus een rol speelt. Met dominant wordt aangeduid dat het allel welke het gebrek veroorzaakt, het bijbehorende allel voor de normale eigenschap (het zogenaamde wildtype) onderdrukt. Het normale allel, dat onderdrukt wordt, wordt recessief genoemd. Alle dieren die het dominante allel bezitten (homozygoot of heterozygoot) zullen bij volledige penetrantie het gebrek vertonen. Dieren die fenotypisch vrij zijn zullen dan zeker homozygoot vrij zijn. Wanneer het defect volledig penetrant is, zal het geen generatie overslaan, het kan niet ongemerkt aanwezig zijn in dragers.
Een voorbeeld van een enkelvoudig dominante ziekte is EhIers-Danlos syndroom bij de Springer spaniŽl (Kirk, 1986).
1. 1. 1.3 enkelvoudig recessief
Hierbij wordt het mutant allel onderdrukt door het dominante normale allel. Een dier met genotype "RR" (homozygoot dominant) is vrij van de ziekte, een dier met genotype "rr" (homozygoot recessief) is aangetast: het is een lijder.
Heeft het dier genotype "Rr" (heterozygoot), wil dit zeggen dat de ziekte niet tot uiting komt, maar dat het dier wel drager is van het afwijkende gen en dit door kan geven aart zijn nakomelingen. Hierdoor kan het lijken of de ziekte generaties overslaat. Deze dragers zijn aan de hand van klinische symptomen niet te detecteren, wat het opsporen van dragers van recessieve gebreken niet evident maakt.
Een voorbeeld van een enkelvoudig recessieve afwijking is PRA bij de hond.
1.1.1.4 geslachtsgebonden overerving
Bij deze vorm ligt het afwijkende gen op een of beide X-chromosomen of op het Y-chromosoom. Ook hier kan het allel dominant of recessief zijn.
Bij de X-gebonden, dominante afwijking zijn vooral de vrouwelijke dieren fenotypisch afwijkend. De mannelijke dieren geven de afwijking immers wel door aart hun dochters, maar niet aart hun zoons. Verder heeft elke nakomeling met het defect ook een ouder die het defect vertoont, mits volledige penetrantie (Nicholas, 1987).
Bij de X-gebonden recessieve afwijking vertonen vooral de mannelijke dieren de afwijking, omdat deze slechts een X-chromosoom hebben, dat dan ook niet gedomineerd kan worden door het dominante normale gen, wat Bij de vrouwelijke dieren wel het geval is. Bij deze recessieve vorm hoeft het kenmerk niet in elke generatie fenotypisch zichtbaar te zijn, het kan generaties overslaat. Een voorbeeld van een X-gebonden recessieve afwijking is hemofilie (Thrusfield, 1988).
Zelden wordt een defect overgedragen via het Y-chromosoom. Dit chromosoom wordt alleen overgedragen aan de mannelijke nakomelingen, en dus komt deze afwijking alleen Bij de mannelijke dieren voor. Een voorbeeld hiervan is behaarde oorranden Bij de, mens (Thrusfield, 1988).
1. 1. 1.5 dominant met on volledige penetrantie
Niet altijd vertonen dieren met eenzelfde genotype voor een bepaald kenmerk dezelfde fenotypische expressie. Bij deze vorm van overerving wordt de afwijking door een dominant gen overgebracht, maar deze komt niet altijd tot uiting waar hij normaal gezien wel tot uiting zou komen. Dit fenomeen kan ontstaan door genetische (polygeen) of milieu-invloeden. Onvolledig dominante afwijkingen vertonen een moeilijk herkenbaar patroon van overerven. Deze afwijkingen kunnen namelijk een generatie overslaat, iets wat Bij de dominante overerving met volledige penetrantie niet mogelijk is.
Een voorbeeld van dominante overerving met onvolledige penetrantie, is mandibulair prognathisme Bij de mens (Peelman, 1997).
1. 1. 1.6 recessief met on volledige penetrantie
Bij deze vorm wordt het kenmerk recessief overgedragen, maar deze kan onderdrukt worden door bijkomende genen met een modificerende werking of door milieu-invloeden. Hierdoor wordt het zeer moeilijk een patroon van overerven te herkennen (Thrusfield, 1988).
Een voorbeeld hiervan is musculaire hypertrofie Bij het Belgisch wit-blauwe vlees vee (Peelman, 1997).
1.1.1.7 polygene overerving
Deze vorm van overerving verklaart in sommige gevallen de onvolledige penetrantie. Bij polygene overerving is er een gecombineerd effect van meerdere genen (major genes en minor of auxiliary genes). Major genes en minor genes erven onafhankelijk van elkaar over volgens de wetten van Mendel. Door gelijktijdige inwerking op bepaalde biochemische processen beÔnvloede ze elkaar. Het onafhankelijk overerven en gelijktijdig inwerken zorgt voor een scala aan uitingsvormen. Dit maakt dat het zeer moeilijk wordt het patroon van overerven te herkennen.
Enkele voorbeelden hiervan zijn entropion en trichiasis (Stades, 1996).
1.1.2 milieu-invloeden
Ook niet-genetische factoren kunnen invloed hebben op het fenotype en onvolledige penetrantie verklaren. Zo beschrijft Nicholas (1987) dat de voeding en de lichaamsbeweging van de jonge pup een rol spelen bij het ontstaan van heupdysplasie. Dit maakt dat het nog moeilijker wordt om de wijze van overerven te achterhalen. Er kan verondersteld worden dat heupdysplasie recessief overerft met onvolledige penetrantie. Er zijn echter ook aanwijzingen voor invloed van allelen van andere loci. Gebreken zoals heupdysplasie noemt men daarom multifactorieel overervende kenmerken, omdat ze zowel door verscheidene genetische (polygene) factoren als door milieu-invloeden bepaald worden.
Uit dit alles kan eenvoudig besloten worden dat het gevaar op een on opmerkte exponentieel, verspreiding van multifactoriŽle aandoeningen zeer groot is.
1.2 KWANTITATIEVE GENETICA
1.2.1 Fenotype = Genotype + Milieu (F = G + M)
Dat het genotype van een dier de resultante is van genotype en milieu is reeds in de kwalitatieve genetica tot uiting gekomen. De verdere uitwerking van deze wetmatigheid op populatieniveau leidt tot verder uitsplitsen van G en M. Via verschillende tussenstappen bekomt men lineaire vergelijkingen die de basis vormen van de fokwaardeschatting. Het belang van deze wetmatigheid binnen deze problematiek is miniem. Er wordt hier ook niet verder op ingegaan.
1.2.2 wet van Hardy-Weinberg
Binnen de populatiegenetica is dit een van de belangrijkste wetmatigheden. Deze wet zegt dat de genenfrequenties en de genotypenfrequenties constant blijven van de ene generatie op de volgende. Er zijn echter wel enkele belangrijke voorwaarden; er moet in de populatie ad random paring zijn en er mag geen selectie, mutatie, migratie of genetische drift zijn. Wanneer aart deze voorwaarden is voldaan, verhouden de genotypenfrequenties in de populatie zich tot elkaar in zogenaamde Hardy-Weinberg proporties. Hierbij verhouden de genotypes RR, Rr en rr zich als p kwadraat, 2pq en q kwadraat, waarbij p de genfrequentie van R en q die van r is.
Een belangrijke toepassing van deze wet is, dat men de genotypenfrequenties kan berekenen en voorspellen.
Zo kan men uitrekenen hoe groot de groep dragers van een enkelvoudig recessief gebrek zal zijn in een populatie, wanneer bekend is hoeveel lijders er zijn. Wanneer er bijvoorbeeld 5 lijders (rr) van het gebrek r per 1.000 dieren zijn, is de berekening als volgt:
2 Aantal lijders = q kwadraat = 0,005 (genotypefrequentie van rr)
q = 0,07 (=genfrequentie van r)
p + q = 1 dus p = 1 - q =
1 - 0,07 = 0,93
Aantal dragers = 2pq (= genotypenfrequentie van Rr)
= 2 x 0,93 x 0,07 = 0,13 = 13 %
Aantal vrije dieren = P kwadraat (= genotypenfrequentie van RR)
= (0,93)2 = 0,86 = 86 %
Dit lijkt een verbazend hoog aantal, maar dit blijkt algemeen te gelden voor alle zeldzame recessieve kenmerken (Nicholas, 1987). Logisch, want q is altijd kleine dan 1, waardoor q altijd groter is dan q kwadraat. Als p niet kleiner wordt dan q, zal 2pq 2 altijd groter zijn dan q kwadraat.
De bruikbaarheid van de wet van Hardy-Weinberg kan geÔllustreerd worden aan de hand van een praktijkvoorbeeld. Let hierbij op het hoog aantal dragers in de populatie dat men bekomt.
De Nederlandse vereniging voor de Drentse patrijshond heeft in de jaren '80 hun honden onderzocht op PRA: toen zo'n 913 honden fenotypisch onderzocht waren, bleken daarvan 88,7 % vrij, 5,8 % niet-vrij, en 5,4 % 'voorlopig niet-vrij (dit betekent dat er kleine afwijkingen gevonden werden, die mogelijks in het beeld van PRA vallen). Neemt men aan, dat van de laatste groep ongeveer de helft ook PRA-lijder is, dan komt men tot een groep van ca. 9 % lijders. Is dit een ad random populatie, dan kan men met de wet van Hardy-Weinberg berekenen, dat er dan maar liefst 42 % dragers zijn (Stades, 1982).
p 2=9%=0,09 p = -\/0,09 = 0,3
q = 1 - p = 1 - 0,3 = 0,7
Aantal dragers = 2pq = 2 x 0,3 x 0,7 = 0,42 = 42 %
1.3 MOLECULAIRE GENETICA
Gegroeid uit de biochemie neemt deze tak van de genetica een steeds belangrijkere plaats in. De biotechnologische methoden bieden de mogelijkheid rechtstreeks op DNA-niveau naar afwijkingen te zoeken. Uit de verdere bespreking zal duidelijk het belang van de moleculaire genetica in het oplossen van de problematiek rond dragers tot uiting komen.
1.4 SELECTIE
Wanneer men dieren met een dominant overervende afwijking niet inzet voor de fokkerij ( d.i. selectie tegen de dominante afwijking), zal dit gebrek snel uit de populatie verdwijnen. Zet men geen enkel dier met de afwijking in, zal dit defect zelfs in een generatie verdwenen zijn. Wanneer de selectie minder streng is, zullen er daarvoor meerdere generaties nodig zijn. De daling in genfrequentie is dan afhankelijk van: 1. de mate van selectie, oftewel de selectie-coŽfficiŽnt en 2. de frequentie van het dominante gen. Uit de figuur (fig.1) blijkt, dat er zelfs bij een wat minder strenge selectie toch nog een snelle daling van de genfrequentie gebeurt.
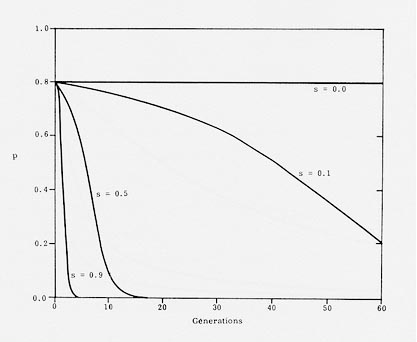 |
fig. 1. Resultaten van selectie tegen een dominant gen (p). Er wordt gestart met een frequentie van 0,8. De mate van Selectie wordt weergegeven door s (uit Nicholas,1987).
Wanneer men echter selecteert tegen een recessief overervende afwijking, ziet men dat dit veel langer duurt. Men kan immers alleen de homozygoot recessieve dieren detecteren en vervolgens uitsluiten van de fokkerij. De heterozygote dieren blijven onopgemerkt in de populatie. Het is zelfs niet altijd mogelijk alle homozygote dieren te herkennen, omdat zij bijvoorbeeld (nog) geen symptomen vertonen. Dit heeft tot gevolg dat in dit geval de mate van selectie lager is.
Uit de volgende figuur (fig.2) blijkt dat zelfs bij intensieve selectie er vele generaties nodig zijn om de frequentie van voorkomen te doen dalen en dit in een steeds trager ritme. Volledig uitroeien van een recessieve afwijking is dan ook onmogelijk bij deze manier van selectie.
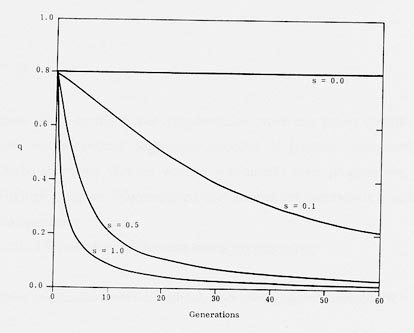 |
Het is daarom van het grootste belang om de heterozygote dragers van recessieve afwijkingen te detecteren. Enkel dan kan men snelle vooruitgang boeken bij selectie tegen het recessieve gen (Nicholas, 1987).
2 EEN VOORBEELD VAN EEN RECESSIEF OVERERVENDE AFWIJKING:
PRA
2.1 WAT IS PRA ?
Progressieve retina atrofie is een verzamelnaam voor een groep erfelijke primaire dysplasieŽn met secundaire degeneratie (atrofie) of primaire degeneratie van de retina. De belangrijkste Vormen worden gekenmerkt door progressieve, irreversibele afwijkingen van de fotoreceptoren met secundaire degeneratie van de andere retinale componenten.
Stades et al. (1996) onderscheiden een aantal hoofd-groepen:
1. erfelijke progressieve nachtblindheid, voorheen gegeneraliseerde PRA genoemd,
2. erfelijke (stationaire) nachtblindheid,
3. erfelijke (stationaire) dagblindheid,
4. pigment epitheel dystrofie (PED), voorheen dag-/tunnelblindheid of centrale PRA genoemd.
Omdat alleen van de eerste vorm. bewezen is hoe deze overerft, nl. enkelvoudig recessief zal verder alleen over deze gegeneraliseerde vorm van PRA gesproken worden. Deze vorm. kan verder worden onderverdeeld in verschillende subvormen. Deze onderverdeling is gebaseerd op het verschil in leeftijd waarop de symptomen optreden.
a. vroege vorm
Hierbij zijn de staafjes en/of kegeltjes verkeerd aangelegd (dysplastisch) en zullen zij ook al vroeg degenereren. De dieren worden dan ook al vroeg nachtblind (binnen de eerste 6 maanden) en als de dieren P2 jaar oud zijn, zijn ze volledig blind. Hierbij ziet men dus reeds op geslachtsrijpe leeftijd symptomen.
Gepredisponeerde rassen zijn onder andere: Ierse en Gordon setter, collies, shelties, Noorse elandhond (Bedford, 1989).
b. late vorm
Hierbij zijn de staafjes normaal aangelegd en degenereren ze ook later. Nachtblind worden de dieren op 3-5 jaar, blind pas op 6-9 jaar, dus hier worden de symptomen pas zichtbaar als de dieren de reproductieleeftijd reeds lang bereikt hebben.
Enkele rassen: poedels, Drentse patrijshond, schapendoes, Engelse en Amerikaanse cocker spaniŽl & (Stades et al, 1996).
c. tussenvormen
bij deze tussenvormen worden de dieren nachtblind op 1-2 jaar en blind op 3-5 jaar, zoals onder andere bij de dwergschnauzer, Tibetaanse terriŽr en de labrador retriever (Stades et al, 1996).
Er zijn ook rassen waarbij twee verschillende vormen voorkomen, onder andere bij de elandhond, lerse setter, dashond en Schotse herder.
* wijze van overerven:
Deze vormen erven enkelvoudig recessief over. Dit betekent echter niet dat zij via hetzelfde gen worden overgedragen. Zo blijven bijvoorbeeld uit een kruising tussen een collie en een setter, beide lijder, geen lijders voort te komen (Stades et al, 1996).
Bij de lerse setter zijn 2 vormen van PRA beschreven; de eerste vorm is de vroege vorm, die zowel in Europa als in de USA voorkomt, de tweede vorm is een minder voorkomende vorm, die alleen in de USA voorkomt en pas op late leeftijd verschijnt. Dit maakt de bestrijding in Amerika alleen maar moeilijker (Bedford, 1989).
Bij de lerse setter is van de vroege (en meest voorkomende) vorm het defecte gen achterhaald. Het blijkt te gaan om een mutatie in het gen voor de beta-subeenheid van cGMPfosfodidsterase. De mutatie, een G -> A transitie, maakt van codon 807 een stopcodon waardoor een polypeptideketen wordt aangemaakt die de laatste 49 aminozuren mist (Petersen-Jones et aL, 1995). Biochemisch is dit te meten als een abnormale opstapeling van eGMP voorafgaand aan de retinadegeneratie (PetersenJones et a], 1995).
* symptomen:
In het begin valt het de eigenaar op dat de hond schrikachtig wordt bij schemer. Gezichtsvermindering bij schemer is namelijk een van de eerste symptomen. Bij diergeneeskundig onderzoek vertoont de hond mydriasis en vertraagde pupilreflexen. Op welke leeftijd de symptomen beginnen is afhankelijk van het ras en kan variŽren van enkele maanden tot 4-5 jaar (tabel 1). De aandoening verloopt progressief en de dieren worden uiteindelijk volledig blind (Stades, 1996)
tabel 1 leeftijdsverschillen van ontstaan van PRA bij hondenrassen uit Groot-Brittanie (ult Bedford, 1989).
A Three to 24 months
Miniature longhaired dachshund
Cardigan Welsh corgi
Cairn terrier
Irish setter
Rough collie
Smooth collie
B Twelve to 18 months
Norwegian elkhound
C Twelve to 30 months
English springer spaniel Tibetan terrier Tibetan spaniel
D Twenty-four to 48 months
English cocker spaniel
E Thirty-six to 60 months
Toy poodle
Miniature poodle
Ophthalmoscopisch ziet men eerst kleurveranderingen en hyperreflectie in de periferie van het tapetum lucidum en de retinale vaatjes worden dunner. Uiteindelijk is de atrofie compleet; de retinavaatjes zijn dan nog slechts schimmen en de papil is bleek en atrofisch. Vaak treedt in het eindstadium cataract op (Peiffer en Petersen-Jones, 1997).
* diagnose
Deze kan worden gesteld aan de hand van de symptomen en door middel van ophthalmoscopisch onderzoek. Ook een retinogram kan de diagnose bevestigen. Door namelijk de, retina lichtstimulatie, te geven kan men electrische potentialen opwekken. Dit geeft informatie over de, lichtgevoelige activiteit van de fotoreceptoren, het pigmentepitheel en de schakelcellen (Aguirre en Rubin, 1975). Men moet echter wel opletten dat het electroretinogram op de juiste leeftijd genomen wordt (Nijsse, 1995).
* behandeling
Een behandeling is niet bekend.
* Prognose
De prognose voor het gezichtsvermogen is zeer slecht. In het begin van de aandoening zullen de dieren wat schrikachtig zijn, wat extra aandacht vergt van de eigenaar, maar zelfs als de honden volledig blind zijn kunnen zij zich vaak prima handhaven in een voor hen bekende omgeving. Vaak kunnen zij nog met ballen spelen en zelfs springen over (bekende) hindernissen is meestal nog mogelijk (Stades et al, 1996).
2.2 EVOLUTIE OP POPULATIENIVEAU: HET BELANG VAN DRAGERS
VAN PRA
2.2.1 theoretische benadering
Als men de verspreiding van een enkelvoudig recessieve ziekte gaat bekijken, komt het belang van dragers sterk naar voren. Dragers zullen namelijk de defecte genen ongemerkt in de populatie verspreiden. Bij het inzetten van een drager, die geen symptomen vertoont, zal de helft van zijn nakomelingen ook drager zijn en deze zullen het op hun beurt ook weer doorgeven. Zo zal het defecte gen zich in de populatie verspreiden en pas als deze nakomelingen onderling gekruist worden (inteelt!) zullen er lijders, dus dieren met klinische symptomen, te voorschijn komen.
Stel dat in een populatie met 100 vrije teven (RR) een drager reu (Rr) wordt ingezet. Brengt een teef gemiddeld 6 pups per nest voort, worden er in de eerste generatie 600 pups geboren. In deze F,-generatie zijn er 50 % RR en 50 % Rr dieren, dus 50 % is drager. Bij nieuwe selectie wordt hieruit een tweede reu gekozen; deze is ofwel RR (50 % kans) ofwel Rr (50% kans). Dit dier wordt ingezet in een populatie met 50 % RR en 50 % Rr.
Er zijn dan 2 mogelijkheden:
1. Indien deze dekreu vrij is kruist men RR met 50 % RR en 50 % Rr. Hieruit komen in de F27generatie 50 % + 25 %= 75 % RR en 25 % Rr. Wanneer men nu deze groep dragers uit de F27generatie gaat kruisen met de eerst gebruikte reu (kleindochter-kleinzoonparing) dan krijgt men in de derde generatie problemen.
2. Indien deze reu drager is kruist men Rr met 50 % RR en 50 % Rr. Hier worden reeds dragers met elkaar gekruist in de F,-generatie. Dit levert in de F2 generatie 25 % RR + 25 % Rr + 12,5 % RR + 25 % Rr + 12,5 % rr. Dit zijn dus 37,5 % vrije dieren RR, 50 % dragers Rr en 12,5 % lijders. Op twee, generaties tijd ontstaan al zware problemen.
Deze theoretische benadering kan slechts in beperkte mate de complexiteit van het probleem uitleggen. Naast de keuze van de reu en de graad van inteelt spelen de manier van overerven, de graad van aantasting van de fokteven en milieuomstandigheden een rol in de evolutie op populatieniveau (Nicholas, 1987).
In de hondenfokkerij wordt ernaar gestreefd de fokdieren zoveel mogelijk fokzuiver te maken voor de rastypische kenmerken. Een veel toegepaste methode hierbij is het intelen en vooral het in bepaalde lijnen steeds weer terugkruisen op topdieren, die alle gewenste kenmerken vertonen. Volgens Bouw (1991) toont onderzoek van stambomen van honden dan ook aan dat bepaalde topfokdieren op bijna elke stamboom voorkomen en dat deze dan vaak in het voorgeslacht van zowel moeder.
2.3 GEVOLGEN VAN INBRENGEN VAN ERFELIJKE GEBREKEN IN DE POPULATIE
2.3.1 theoretische benadering
2.3. 1.1 gevolgen voor het dier zelf
Op individueel vlak zijn de gevolgen van het gebrek in relatie met de ergheid van de symptomen; zo zal het ontbreken van de staart minder erg zijn dan een ernstige hartafwijking.
2.3.1.2 gevolgen voor de populatie
Fokkers zullen op hun manier het gebrek "er uit fokkend', door hun aangetaste dieren (Lijders of dragers) te kruisen met dieren uit andere families die wel vrij zijn in het gebrek. Dit is echter geen definitieve oplossing, het camoufleert alleen maar het gebrek. Ondertussen wordt het gebrek steeds verder verspreid in de populatie en wordt een zeer groot deel van de populatie besmet (Stades, 1991).
Door uitvoer van dragers kan het gebrek internationaal verspreid worden. Zeker als de fokkers in het land van oorsprong op de hoogte zijn van het erfelijke defect en weten hoe zij dit gebrek binnen hun dieren verborgen moeten houden (Bouw, 1991). Wanneer deze honden in het land van bestemming kunnen bijdragen tot het bestendigen van de gewenste kenmerken, kan het defect zich ook in dit nieuwe land sterk pan verspreiden.
Het andere extreem is dat, indien lijders van de fokkerij uitgesloten worden of vroegtijdig sterven, er een verenging van de fokbasis kan ontstaan, of dat het ras zelfs kan uitsterven. Vooraleer een zeer streng fokbeleid uit te voeren, moet men zich daarom bedenken of er wel voldoende rastypisch materiaal overblijft. Als er zich dan ook nog andere erfelijke ziektes voordoen in de populatie, kan men bedenken dat de prognose voor het ras problematisch wordt (Stades, 1982).
Sluit men ook de dragers uit van de fokkerij, betekent dit een nog verder verengen van de fokbasis en verliezen van de gewenste eigenschappen.
2.3.2 praktijkvoorbeelden
2.3.2.1 Drentse Patrijshond
Eind jaren '70 heeft de, rasvereniging besloten niet alleen de lijders maar ook de dragers uit te sluiten van de fokkerij. Van de totale populatie, toen zo'n 5000 dieren, werden ongeveer 2500 honden uitgesloten van de fokkerij omdat ze lijders waren of een grote kans hadden drager te zijn. De helft van de, genetische basis is hierbij dus weggevallen. Dit betekent een enorme verenging van de fokbasis.
2.3.2.2 Lhasa Apso
Het inbrengen van PRA in dit ras in BelgiŽ door invoer van dragers, zoals reeds eerder vermeld, illustreert dat de, gevolgen van deze dragers zich niet alleen op, nationaal niveau bevinden.
2.4 mogelijke OPLOSSINGEN
Een goed bestrijdingsplan op stellen dat enerzijds de gewenste kenmerken in de, populatie behoudt en anderzijds de ongewenste minimaliseert, is alleen mogelijk als men de dragers in een zo vroeg mogelijk stadium opspoort.
2.4.1 Overzicht van verschillende opsporingstechnieken
In de loop der tijden zijn er een aantal technieken ontwikkeld om dragers op, te sporen. De oudere technieken zijn vaak tijdrovend en minder betrouwbaar dan de moderne technieken. Deze geven ook een directer resultaat, daar zij rechtstreeks het genoom onderzoeken. Spijtig genoeg zijn voor slechts een beperkt aantal genetische gebreken dergelijke testen ontwikkeld.
1. stamboomanalyse
Dit is de oudste techniek, maar nog altijd de meest gebruikte. Het begint met een screening van de populatie, waarbij alle gekende lijders in een stamboom in kaart worden gebracht. Als nu een dier lijder is van een recessieve afwijking, wil dit zeggen dat beide ouders zeker drager zijn. De grootouders hebben dan 50 % kans om drager te zijn, de overgrootouders 25 %, enz. Als 2 van deze grootouders samen een nakomeling hebben, heeft deze een kans van 1/4 x 1/4, dus 1/16. Zo kan men voor elk met een lijder verwant dier de kans op dragerschap uitrekenen (Bouw, 1991). Voor deze techniek is het uiteraard wel noodzakelijk dat alle gegevens wat betreft afstamming, tatoeagenummer (of andere registratiemethode, zoals chip ed.) betrouwbaar zijn.
In Nederland is er een stichting, nl. de W.K. Hirschfeldstichting in Utrecht, waarheen dierenartsen, die een dier onderzocht hebben op bepaalde afwijkingen, zoals bijvoorbeeld heupdysplasie of PRA, hun bevindingen doorsturen. Op deze manier kan men de populatie goed in beeld brengen en wordt een eventueel nieuw ingebracht erfelijk gebrek sneller gesignaleerd (Nijsse, 1996).
Bedford (1989) wijst erop, dat hiervoor "the whole-hearted support" van de rasclubs nodig is, waarbij alle resultaten van de oogonderzoeken, zowel de slechte als de goede, naar een centraal registratiepunt gaan.
2. testkruisingen
Hierbij wordt een te onderzoeken dier gepaard met een gekende drager of lijder. Als het gekende dier een lijder is en het te onderzoeken dier is drager, heeft een nakomeling 50 % kans om van beide ouders het defecte gen te krijgen en dan is de nakomeling een lijder, die dus gedetecteerd kan worden. Men weet dan zeker dat het te onderzoeken dier het defecte gen heeft, dus drager is. Er is echter ook 50 % kans dat de nakomeling het defecte gen van het te onderzoeken dier niet krijgt, dus alhoewel het te onderzoeken dier het defecte gen wel kan dragen, wordt dit niet gedetecteerd. Er is dus 50 % kans dat het te onderzoeken dier niet herkend wordt als drager. Bij 2 nakomelingen is de kans dan dat een drager niet gedetecteerd wordt 1/2 x 1/2 = 25 %. Willen we nu deze kans onder 5 % stellen, zullen we 5 nakomelingen moeten hebben, je hebt dan nl. nog (112)s = 1/32 oftewel 3 % kans. Wil men nog meer zekerheid, bijvoorbeeld minder dan 1 %, dan zijn er 7 nakomelingen nodig (Nicholas, 1987).
Deze testkruisingen hebben verscheidene nadelen. Zo is deze methode niet geschikt voor defecten die pas op latere leeftijd zichtbaar worden. Wanneer een dier 90edgekeurd wordt voor de fokkerij is hij al voorbij zijn reproductieve leeftijd of reeds dood. Een tweede nadeel is dat deze methode kostbaar en tijdrovend is (Bouw, 1991). Verder moet men zich afvragen wat men met de nakomelingen uit deze kruisingen gaat doen. Fokkers zullen er niets voor voelen deze (het defect dragende) dieren weg te geven. Het maakt voor hen het aantal potentiŽle kopers van pups alleen maar kleiner en enkel door sterilisatie heeft men zekerheid dat er niet mee gefokt wordt (Willis, 1989).
Een tweede mogelijkheid is daarom om testkruisingen te doen met dragers in Plaats van lijders. Als het te onderzoeken dier drager is, is de kans 1/4 dat een nakomeling zuiver is van de ziekte, dus 3/4 dat het dier geen symptomen gaat vertonen. In dit geval zijn er wel meer nakomelingen nodig vooraleer de kans dat het dier niet als, drager herkend wordt onder de 5 % ligt. Er zijn dan 9 normale nakomelingen nodig (Bouw, 1991).
3. biochemisch onderzoek
Van sommige genetische ziektes is de onderliggende biochemische afwijking gekend. Door het zogenaamde gendoseringsfenomeen komen bij (heterozygote) dragers van sommige gendefecten bepaalde biochemische substanties in een lagere concentratie voor dan bij normale dieren. Door de enzyme-activiteit in weefselextracten of bloed te meten kan men deze dragers achterhalen (Nicholas, 1987). Hiervoor moeten de benodigde weefsels gemakkelijk en veilig verkregen kunnen worden, zoals bijvoorbeeld plasma (Jolly en Healy, 1986). Dit maakt dat hier geen mogelijkheden liggen voor oogafwijkingen zoals PRA.
4. moleculair-genetische test (DNA-test)
Dit is de meest moderne techniek. Deze test maakt gebruik van de PCR-techniek om het benodigde gen te vermenigvuldigen, waarna het geidentificeerd wordt met behulp van een andere techniek. Het grote voordeel van deze test is, dat men deze al bij de jonge pups kan uitvoeren, wat een grote tijdwinst geeft. Bovendien worden met deze techniek niet alleen de aangetaste dieren, maar ook de dragers achterhaald.
Hiervoor moet men eerst de genetische basis van de ziekte tot op DNA niveau achterhalen. Voor enkele defecten is dit reeds gelukt (Peelman et al, 1996), maar voor de meeste afwijkingen is dit helaas nog niet het geval.
2.4.2 Enkele uit de praktijk van de huidige benadering van de PRA problematiek bij verschillende hondenrassen
2.4.2.1 Drentsche patrijshond
Bij de Drentsche patrijshond kan men een hond ophthalmoscopisch pas vrij verklaren op 5 jarige leeftijd. Als een hond dan echter symptomen vertoont, kan men met zekerheid zeggen dat beide ouders drager zijn, of, in het geval dat de hond vrij wordt verklaard, dat de ouders geen drager zijn. Deze ouderdieren zijn dan zo'n 6-7 jaar, wat dan al bijna te oud is om nog veel invloed op de fokkerij te kunnen uitoefenen (Stades, 1982). Het is daarom zeer belangrijk de diagnose zo vroeg mogelijk te stellen. De vereniging voor de Drentsche patrijshond laat hun honden voor de eerste keer onderzoeken als zij 18 maanden oud zijn, daarna zijn de fokkers verplicht hun honden jaarlijks te laten onderzoeken tot de honden 5 jaar oud zijn.
2.4.2.2 lerse setter
Bij de lerse setter kan men al op zeer jonge leeftijd vaststellen of een dier PRA heeft en daarom heeft men destijds in Engeland gekozen voor proefparingen. Een gekende lijder werd daarbij gekruist met een hond, waarvan men het genetisch patroon wilde weten. Komen er afwijkende pups uit deze combinatie, dan weet men dat de hond drager is en als er bijvoorbeeld 5 normale nakomelingen geboren zijn, is de kans dat het betreffende dier toch drager is nog slechts 1/32, dus minder dan 5 %. Deze methode heeft destijds veel succes gehad (Stades, 1982). Thans worden in Engeland geen proefparingen meer uitgevoerd, maar berust de controle vooral op routinematig ophthalmoscopisch onderzoek met registratie op vrijwillige basis, terwijl er geprobeerd wordt jaarlijks ophthalmologisch onderzoek te verplichten via het "BVA/KC/ISDS Eye Examination Scheme" (Bedford, 1989).
Nadat voor de lerse setter het defecte gen achterhaald werd, is er in de Verenigde Staten nu voor PRA bij de lerse setter een moleculaire diagnostische test ontwikkeld die routinematig gebruikt kan worden om de mutatie op te sporen. De test gebruikt de PCR-techniek (polymerase chain reaction) om een deel van exon 21 (waarin codon 807) te vermenigyuldigen. Er wordt een primer toegevoegd die het gemuteerde gen herkent. Hierdoor wordt DNA gevormd met een herkenningsplaats voor het restrictie enzyme Bfa 1 (Clements et aL, 1993). Wordt het niet gemuteerde gen vermenigvuldigd, dan ontstaat een herkenningsplaats voor restrictie enzyme Bsr 1 (Ray et w., 1994). Na toevoegen van deze enzymes kan men dan door middel van electroforese vaststellen of het DNA geknipt is en door welk enzyme.
2..4.2.3 Tibetaanse Terrier
Voor de Belgian Tibetan Terrier Club is ook jaarlijks oogonderzoek verplicht, aldus mem Christine Nies (persoonlijke mededeling, 1998). Sinds september 1997 worden alle attesten naar haar opgestuurd en sindsdien waren er geen dieren die symptomen van PRA vertoonden. Echter ook hier is het zo dat er voor het stamboek geen verplicht oogonderzoek is, dit is alleen voor de club en de pupbemiddeling het geval.
2.4.2.4 Lhasa Apso
Het probleem van de Lhasa Apso illustreert, dat tegenwoordig ook internationaal overlegd moet worden over de aanpak van erfelijke problemen, anders wordt het probleem alleen maar groter. De Engelse rasclub (Millet, 1998) waarschuwt daarom om bij invoer van een dier uit Engeland te vragen naar de certificaten, waaruit blijkt dat het dier ophthalmoscopisch vrij verklaard is van PRA. Dragers worden hierdoor echter niet onderkend.
2.5 ALGEMEEN BESLUIT
Het is duidelijk dat het een complexe materie betreft. Het is zaak dat alle betrokken partijen hun verantwoordelijkheden kennen en passende maatregelen nemen, daarover zijn de verschillende auteurs (onder andere Bedford, 1989 en Willis, 1989) het eens. Dit geldt niet alleen voor de fokkers, wie vaak verweten wordt teveel honden en teveel defecten te fokken (Willis, 1989). De rasverenigingen of beter nog overkoepelende organisaties dienen in bepaalde gevallen een fokbeperking of -verbod in te stellen. Het weigeren van stamboekpapieren bij het niet kunnen voorleggen van de gevraagde attesten is het enige pressiemiddel. Ook de dierenartsen hebben een taak. Wanneer fokkers bij hen komen met een hond met een erfelijke (oog)afwijking, moet hen erop gewezen worden dat zij beter niet met deze hond kunnen fokken. Vooral moet hen uitgelegd worden waarom dit zeer belangrijk is. Ook moeten ze beseffen dat het niet bekend maken van een gediagnosticeerde afwijking, de problemen alleen maar zal verdoezelen (Willis,1989).
De ultieme oplossing is dat voor PRA (en andere afwijkingen) een DNA-test ontwikkeld wordt. Dit is immers de enige manier om voor 100 % zeker te zijn of het dier drager is van het afwijkende gen of niet. Bovendien kan men deze test al bij de jonge pup uitvoeren, wat bovendien een enorme tijdwinst geeft. Het ontwikkelen van DNA-testen kan een nieuwe dimensie aan de diagnostiek binnen de kleine huisdierenpraktijk toevoegen.
copyright,legal and email statement