|
|
|
|
PRA special by Mr. Frank van Tatenhove
PRA special door DVM Gerlinde Janssens
KEYWORDS; GENETIC DEFECTS, INHERITANCE CARRIERS, PRA, BREEDING,
THE QUEST for an understanding of how genetic factors contribute to animal disease is gathering speed. Forty years ago, the structure of DNA had just been solved and the precise number of human chromosomes was still under debate. The association between Trisomy 21 and Down's syndrome was on the eve of discovery and a state-of-the-art computer weighed in at 30 tons, covering about 1000 square feet of floor space.
 |
We now know that a dog has 78 chromosomes, that these
chromosomes have ten thousands of basepairs. These coding regions make up only about 2% of
the genome (the function of the remaining 98% is unknown) and some chromosomes have a
higher density of genes than others. A great deal of effort over the past ten
years has been put into creating a physical map of the dog genome - ordering genes within
the genome by placing landmarks to navigate by.
ONE OF THE most difficult challenges ahead is to find genes
involved in diseases that have a complex pattern of inheritance, such as those that
contribute to PRA, cancer, hipdysplasia and neurological defects. In all these cases, no
one gene has the yes/no power to say whether a dog has a disease or not. It is likely that
more than one mutation is required before the disease is manifest. A number of genes may
each make a subtle contribution to a dog's susceptibility to a disease; genes may also
affect how a dog reacts to environmental factors. Unraveling these networks of events will
undoubtedly be a challenge for some time to come.
Eye diseases PRA (progressive retina atrophy) = leads to blindness and is inherited in an autosomal recessive fashion.
This is a disease of the eyes, for the dog will become blind. The retina will have less and less capacity of light absorbing, in approgressive manner through time. There are FOUR stages, 1. progressive generalist PRA , 2. stationary nightblindess 3. stationary dayblindness, 4. PED (Pigment Epithele Dystrophy) , and the varieties of age: young age ( 1-2 ) late ( 3-5 starting and blind at 6-9) years. The intermediary stages are nightblindness at 1-2 and blind at 3-5 years. The difficulty is that the disease inheritance is different in ,as far as we know, all breeds. At this time there is a DNA test for 8 breeds. So these breeders can test at puppy age and the test is guaranteed for life. The risk of entering an hereditary defect in a population such as the Lhasa Apso by using animals that carry such a defect in their genes is explained. These so called carriers can be responsible for spreading the defect without it being noticed, because they show no symptoms, but can pass it through to their offspring. This implicates the great risk of using these animals in breeding programs.
Shown pictures of a normal fundus and different stages of PRA affected eyes.
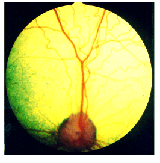 normale fundus |
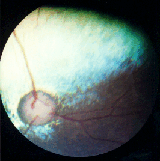 affected fundus |
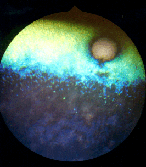 affected fundes with light reflection |
 affected fundes with light reflection |
By studying the Hardy Weinberg law (A2 + 2AB + B2 ) we can see that using carriers over carriers, we will never get loss of the defect, the less we use carriers the more free Lhasa's we will find. The next problem we have is that we can only detect carriers by knowing the positive cases of PRA . That's why it is important that we test all of our breeding dogs , by the optical manual diagnostic method.
Example: PRA samples, If 200 animals were tested, and two cases were found, we find the percentage of affected animals by dividing 2 by 200.
2 / 200 = .01 = 1%
Definitions:
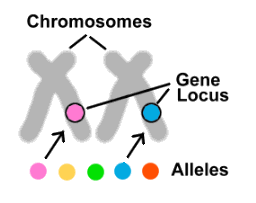
P = gene for the normal (dominant)
p = gene for PRA (recessive)
A = the frequency of the P gene
B = the frequency of the p gene
Since all the genes at each locus must add up to 100% (or 1.0), A
+ B = 1
therefore AP + Bp = 1
But each dog carries 2 genes at the locus concerned, so we have 3 possible genotypes,
PP = genotype of genetically clear animals
Pp = genotype of carrier animals
pp = genotype of affected animals
When a male with genes P and p is mated to a
female with P and p, according to the familiar
quadratic formula, the probable outcome is:
A2 PP + 2AB Pp + B2 pp
If the frequency of the genotype of affected animals is found to be 1% (.01)
(here you substitute the frequency you found in the population)
then B2 = 0.01 and B = 0.1 (the square root of 0.01)
but since B + A = 1, then A = 0.9
Substituting, we get: 0.92 PP + 2(0.9 x 0.1) Pp
+ 0.12 pp
or 0.81 PP + 0.18 Pp + 0.01 pp
Thus the incidence of:
the clear genotype is 0.81 (81%)
the carrier genotype is 0.18 (18%)
the affected genotype is 0.01 (1%)
Another example;
Currently finding DNA markers evenly spread out in the canine DNA. These markers are polymorphic which means they tend to look slightly different in different individuals which means that we could tell by looking at a particular dog which grandparent contributed a certain part of its DNA. If we knew that grandparent carried the disease, we could say that part of the DNA might be responsible for the disease. That's a big might and is made less of a might through large searches over large numbers of pedigrees. here is an example.
Grandparents G1 G2 G3 G4
chromosomes 111111111 222222222 333333333 4444444444
111111111 222222222 333333333 4444444444
mom & dad \mom/ \dad/
111111111 333333333
222222222 444444444
puppies P1 P2 P3 P4
111221122 221121111 111112222 222222111
333344443 444433344 443333444 334444444
Now imagine that grandparents G1 and G4 and puppies P1 and P4 have the disease and we're looking at a recessive mode of inheritance. We would then look at the DNA markers we have and see that at position 7, only P1 and P4 have the DNA from grandparents G1 and G4 and thus, it is possible that the disease gene might be somewhere near that. Now this is very simplistic, but it is the general way we do things.
Now scientists are using human RP genes codes for discovering the dogs genes coding, RP( retinitis pigmentoses) is similar to PRA in dogs so it's easy to use the markers of RP to find the mutations of the different breeds. The universities are currently recalculating the bloodsamples which exist and making plans for a collaborated approach for developing a DNA test in the Lhasa Apso breed.
Example of DNA codes for PRA DNA test in Labrador Retriever breed;
LOCUS CFRHOD 5352 bp DNA MAM 06-FEB-1997
DEFINITION Canis familiaris GENE ENCODING RHODOPSIN.
ACCESSION Y09004
NID g1834398
KEYWORDS rhodopsin.( used for Retinitis pigmentosa FvT)
SOURCE dog.
ORGANISM Canis familiaris
Eukaryota; mitochondrial eukaryotes;Metazoa; Chordata; Vertebrata;
Eutheria; Carnivora; Fissipedia; Canidae; Canis.
REFERENCE 1 (bases 1 to 5352)
TITLE Direct Submission
FEATURES Location/Qualifiers
source 1..5352
/organism="Canis familiaris"
/db_xref="labrador retriever"
/cell_type="Retinal rod cell"
exon <1..440 /etcetera/
BASE COUNT 1171 a 1523 c 1382 g 1276 t
ORIGIN
1 gccctgggtg gccaagtca ggcctccagca gcactcttag gactgagccg cccacggggc
etcetera till basepair = 5341 cggcctaagc cc
//
Halothaan DNA fingerprint
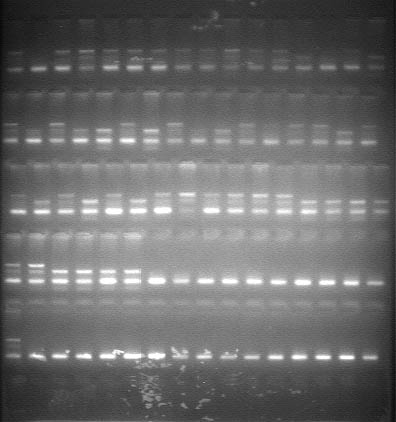 |
On the print you see 3 lighting markers, each little line means a basepair, there is the baseline lighting-up wich indicate here is a free marker,
at the point where you see two lines on top, this indicates a carrier,
at the point where you see a base and a top with a dark space in the middle this indicates a positive marker.
![]()
Progressieve retina atrofie
door Dr Gerlinde Janssens
In het begin van deze eeuw werd deze aandoening voor de eerste maal beschreven bij de Gordon setter. Later volgden nog vele andere rassen. Het equivalent van PRA bij mensen wordt retinitis pigmentosa genoemd.
In het netvlies
zijn er fotoreceptoren die het licht opvangen dat via de lens op het netvlies is terecht
gekomen. Via een reeks chemische reactie wordt dit licht omgezet in een elektrisch
zenuwsignaal (fototransductie cascade). Via de oogzenuw gaan deze signalen verder door
naar de hersenen waar ze als beelden worden waargenomen.
Er zijn 2 soorten fotoreceptoren: vooreerst de staafjes die vooral een functie hebben bij getemperd licht, en de kegeltjes die belangrijk zijn voor het zien bij fel licht en voor de waarneming van kleuren.
In het begin werd
progressieve retina atrofie onderverdeeld in gegeneraliseerde PRA (gPRA) en centrale PRA (cPRA). Voor deze laatste vorm gebruikt men tegenwoordig de term
retinaal pigment epitheel dystrofie (RPED).
Verder wordt er nu een onderverdeling gemaakt bij gegeneraliseerde PRA tussen retina dysplasie en retina degeneratie van staafjes en kegeltjes. Klinisch vertonen beiden heel veel gelijkenis maar er is een verschil in leeftijd bij het optreden van afwijkingen.
Bij dysplasie treden er veranderingen op in de fotoreceptoren (hoofdzakelijk staafjes) vooraleer de retina volledig ontwikkeld is dwz voor de leeftijd van 10 weken. Er is meer variatie in de mate van verlies aan kegeltjes, volgens de verschillende rassen.
Bij degeneratie
daarentegen is de retina op jonge leeftijd nog normaal functionerend. Pas later begint de
degeneratie, worden de eerste afwijkingen van gezichtsvermindering waargenomen en zijn de
eerste veranderingen oftalmoscopisch zichtbaar.
Ook de termen vroege vorm of “early onset” (zoals vb. bij de Collie, Ierse Setter en Cardigan Welsh Corgi) en late vorm of “late onset” (zoals vb. bij de miniatuur Poedel en Engelse Cocker) worden gebruikt. Daarnaast bestaan er nog intermediaire vormen (vb Tibetaanse TerriŽr). Enkel bij de Siberische Husky is een aan het X- chromosoom gekoppelde vorm beschreven. Tot slot zijn er dan ook nog de “niet gedefinieerde vormen” (vb. Australische cattle dog). Om het dan nog complexer te maken is het soms mogelijk dat sommige rassen 2 verschillende vormen hebben, zoals vb. bij de Noorse Elandhond.
Gegeneraliseerde
PRA is steeds bilateraal (beide ogen zijn ongeveer even
uitgebreid aangetast), progressief, en begint met nachtblindheid dwz bij verminderd licht verminderd gezichtsvermogen. De hond aarzelt als
hij van een verlichte plaats naar een donkere ruimte moet gaan. En uiteindelijk komt er
ook dagblindheid bij zodat de hond volledig blind wordt. Dit valt soms pas op in
een vergevorderd stadium omdat de hond zich meestal goed aangepast heeft aan zijn
vertrouwde omgeving. Bij verplaatsen van voorwerpen wordt het wel duidelijker dat de hond
vaak ergens tegen aanloopt.
Als we het netvlies met de opthalmoscoop bekijken zien we in het beginstadium een hyporeflectiviteit, een grijzige kleurverandering aan de rand en in de mid-periferie van de tapetale fundus. Nadien een hyperreflectiviteit van de fundus, op dezelfde plaatsen, dit wijst op een dunner worden van het netvlies. Later zien we ook depigmentatie en hyperpigmentatie van de niet-tapetale fundus.
Soms heeft de
eigenaar al gezien dat de ogen van de hond meer oplichten en dat een groene of oranje
gloed zichtbaar is. De pupillen staan in een gevorderd stadium wijder open en reageren
minder of uiteindelijk niet meer op het licht. We zien ook dat de retinale bloedvaten
dunner worden, eerst de arteriolen en later de venulen. In het eindstadium zijn alle
bloedvaten praktisch verdwenen. De papil (dit is het zichtbare gedeelte van de oogzenuw in
het oog) is veel bleker (door verlies van retinale circulatie) en kleiner geworden (door
verlies van neuraal weefsel).
Bijgevoegd ziet u eerst een afbeelding van een normale fundus (foto 1).

(foto 1)
Foto 2 toont u de fundus van een andere hond waarbij de retinale arteriolen
verdwenen zijn en de venules al dunner worden.

(foto 2)
Op afbeelding 3 ziet u het eindstadium van PRA, alle bloedvaten zijn verdwenen en de oogzenuw is klein en grauw geworden.

De laatste foto toont u een wijd openstaande pupil met een erg oplichtende fundus (foto 4).

(foto 4)
De aandoening is niet pijnlijk voor de patiŽnt. Vaak komt er in een later stadium nog cataract (lenstroebeling) bij. Deze zou veroorzaakt zijn door de invloed van toxische stoffen die uit de degenererende retina vrijkomen.

(foto 5 Lenstroebeling)
In het beginstadium is het soms nodig om voor het oogonderzoek pupilverwijdende druppels te gebruiken. Dan verkleinen de pupillen niet meer onder invloed van het licht en zo kan de periferie van het netvlies beter bekeken worden.
Bevestiging van de
diagnose kan gebeuren aan de hand van een elektroretinografie (ERG). Hierbij worden
lichtstimuli omgezet in elektrische potentialen, die dan geregistreerd worden en op het
computerscherm als uitwijkingen worden weergegeven. Enkel bij gebruik van zeer
gesofisticeerde ERG apparatuur zou het mogelijk zijn om PRA vroeg vast te stellen, dus
vooraleer het moment van verminderd gezichtsvermogen en van netvlies veranderingen.
PRA moeten we onderscheiden van andere aandoeningen van het netvlies die niet erfelijk zijn.
Hiertoe behoort de
post-inflammatoire
retinopatie. In dat geval kunnen de
letsels soms tot een oog beperkt zijn. Indien toch beiderzijds zijn ze niet noodzakelijk
even uitgebreid in beide ogen, dus niet symmetrisch. Om het even welk deel van het
netvlies kan aangetast worden. Eens het letsel inactief is, blijft het verder onveranderd
en breidt dus niet meer uit in tegenstelling tot PRA.
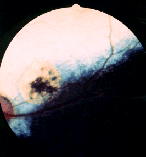
(foto 6 post-inflammatoire retinopatie)
Bij sommige rassen
is al gevonden welke afwijking de aandoening veroorzaakt. Bij de Ierse Setter zou er een
mutatie in het gen voor de beta-subeenheid van cGMP-fosfodiesterase gebeurd zijn. Het
gevolg is dat er een polypeptide-keten wordt aangemaakt die te kort is. Biochemisch is dit
aan te tonen door een abnormale stijging van cGMP. Voor dit ras bestaat er al een
commerciŽle test waarbij de mutatie wordt aangeduid in het PDE6B gen. Het grote voordeel
van zo een test is dat niet enkel honden die de ziekte gaan krijgen vroeg opgespoord
kunnen worden maar ook de dragers van PRA.
De
prcd-(progressieve rod-cone degeneratie) PRA test die
momenteel toegepast wordt voor de Chesapeake Bay Retriever, de Engelse Cocker Spaniel, de
Labrador Retriever en de Portugese Waterdog is een “marker based”-test (linkage
test). Deze rassen hebben een identieke prcd mutatie. Deze mutatie zelf wordt door de test
niet aangetoond maar wel een “vingerafdruk” op chromosoom 9, dichtbij de prcd
locus zelf. Wat betekent dit concreet? De test is gebaseerd op de waarneming dat een
bepaalde “marker “ (dit is een klein stukje niet-functioneel DNA) altijd samen
wordt doorgegeven met een bepaald gen (in dit geval dus de gemuteerde prcd locus) en dat
deze markers niet voorkomen bij genetisch vrije honden. Dit laatste klopt echter niet voor
100%. Dit houdt in dat de test alhoewel geschikt toch bepaalde beperkingen heeft. Dit
houdt verband met “valse allelen”, in dat geval komt de marker voor samen met
een “ouderlijk” normaal gen. De A groep is normaal, ontwikkelt zelf nooit prcd
en kan nooit de prcd genmutatie doorgeven aan de nakomelingen. Bij de B groep wordt
vermeld: waarschijnlijk drager van prcd genmutatie. Men moet rekening houden met vals + in
de B groep, waardoor een klein percentage in deze groep geen drager zou zijn en dus ten
onrechte in deze B groep zou zitten. Maar zeker is dat de honden van de B groep zelf nooit
prcd ontwikkelen. Bij de C groep wordt vermeld: waarschijnlijk homozygoot voor prcd.
Dieren uit deze groep zullen waarschijnlijk wel prcd ontwikkelen. De test kan op om het
even welke leeftijd uitgevoerd worden en de resultaten zullen met de leeftijd nooit
veranderen. Een ander probleem bij het ontwikkelen van testen is het voorkomen van 2
verschillende PRA vormen wat waarschijnlijk het geval is bij de Labrador. Zo is het dan
mogelijk dat een hond, alhoewel hij klinisch alle symptomen vertoont van een PRA vorm bij
een test tot de A groep behoort.
De manier van overerving van de vroege en late vorm blijkt tot op heden bij de verschillende onderzochte rassen steeds eenvoudig autosomaal recessief te zijn. Enige uitzondering tot op heden is de Siberische Husky, waarbij PRA gekoppeld is aan het X chromosoom en dus niet autosomaal recessief wordt overgeŽrfd.
Het is tegen
aangewezen om nog met de ouders van de aangetaste hond verder te kweken omdat ze beiden
zeker drager. Omdat het aangetaste dier zelf 2 copies heeft van het defecte gen zullen
zijn of haar afstammelingen altijd drager zijn. De nestgenoten van de lijder kunnen vrij,
drager of aangetast zijn.
Tot op heden bestaat er nog geen behandeling om het proces van atrofie van het netvlies te stoppen.
Met toestemming van Dr Gerlinde Janssens © info zie link pagina
WARNING; ON THIS SECTION OF MY WEBSTE ARE COPYRIGHT ARTICLES, THESIS , RESEARCH REPORT RESULTS WITTEN BY ME PERSONAL, WRITTEN BY VET'S, ACADEMICS, PHD'S, BY STUDENTS, BY UNIVERSITIES AND PHARMACY COMPANIES ETC. PLEASE CONSIDER IF THE COPYRIGHTS ARE VIOLATED THAT LAWSUIT'S CAN BE DONE!!! FOR USING THIS MATERIAL PLEASE CONTACT ME, copyright,legal and email statement